Химико-аналитический экологический мониторинг

Молярный объем (V0) — это объем одного моля вещества при нормальных условиях. Обычно эту величину используют для газов, в этом случае V0 = 22,4 моль-1. Объемная доля i-го компонента в веществе — отношение объема /‘-го компонента, содержащегося в веществе, к общему объему вещества. Массовое отношение i-го компонента в веществе — отношение массы i-го компонента, содержащегося в веществе, к массе… Читать ещё >
Химико-аналитический экологический мониторинг (реферат, курсовая, диплом, контрольная)
В результате изучения главы 2 студент должен:
знать
- • методы качественного и количественного химического анализа;
- • принципы физико-химических методов анализа, пробоотбор и пробоподготовку;
- • метрологическое обеспечение измерений при мониторинге ОС;
уметь
- • проводить качественный и количественный анализ соединений с использованием физико-химических методов;
- • проводить расчеты концентрации различных соединений;
- • осуществлять анализ и проводить статистическую обработку экспериментальных данных;
владеть
• методами пробоотбора и пробоподготовки, проведения физико-химических измерений и корректной оценки погрешностей при их проведении.
Концентрация вещества
Состав вещества характеризуется количеством (числом частиц) отдельных компонентов пробы и может быть выражен в граммах или других единицах массы. Однако в практических целях состав выражают через концентрацию С компонентов.
Концентрация — величина, определяющая содержание компонента в смеси, растворе, сплаве. Массовая доля i-го компонента в веществе (материале, газе) — отношение массы г-го компонента, содержащегося в веществе, к общей массе вещества (РД 50−160—79). Молярная доля i-го компонента в газе — отношение количества вещества i-го компонента, содержащегося в газе, к общему количеству вещества газа.
Моль — количество вещества системы, содержащей столько же структурных элементов, сколько атомов содержится в нуклиде углерода-12 массой 0,012 кг. Слово «моль» происходит от слова «молекула» (новолат. molecula, уменьшит, от лат. moles — «масса»). Число частиц, содержащееся в моле любого вещества, называют постоянной (числом) Авогадро (A. Avogadro — итальянский физик и химик, 1776—1856) NA,
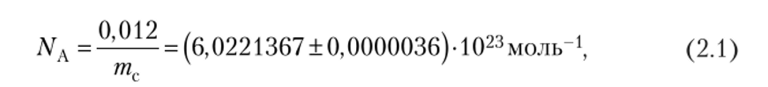
где тс — масса атома углерода.
При обычных расчетах пользуются приближенным значением NA = = 6,022−1023 моль-1. В округленных числах моль содержит, например, 2 г водорода, 32 г кислорода, 18 г воды и т. д.
Погрешность измерения постоянной Лвогадро (в виде относительного среднего квадратического отклонения — СКО) оценивается в настоящее время как 0,59* 10-6.
Число структурных элементов Z можно определить по формуле.

где п — количество вещества в молях.
Структурным элементом может быть молекула, ион, электрон, группа частиц (например, функциональная группа, часть молекулы, ассоциация, радикал и т. п.). Одни структурные элементы существуют реально (молекула Ы2, ион Ю3~), другие — чисто условно (молекула NaCl в растворе, половина молекулы, протон в растворе). Поэтому единица «моль» условных частиц удобна, и обычно ее используют для выражения микрообъектов.
Молярная масса (М) — это масса одного моля вещества. Если имеется вещество массой т, то М = —. Молярная масса имеет размерность г/моль.
п
Численно молярная масса равна относительной молекулярной массе, т. е. суммарной массе всех атомов в частице, отнесенной к 1/12 массе атома углерода. Относительная молекулярная масса — безразмерная величина, ее легко вычислить по таблицам атомных масс элементов.
Молярный объем (V0) — это объем одного моля вещества при нормальных условиях. Обычно эту величину используют для газов, в этом случае V0 = 22,4 моль-1. Объемная доля i-го компонента в веществе — отношение объема /‘-го компонента, содержащегося в веществе, к общему объему вещества. Массовое отношение i-го компонента в веществе — отношение массы i-го компонента, содержащегося в веществе, к массе остальной части вещества.
Массовая, объемная и молярная доли компонентов веществ смесей — относительные величины, поэтому их единицами являются доли единицы, проценты (%), промилле (%о), миллионные доли (ppm), миллиардные доли (ppb), триллионные доли (ppt).
Способы выражения концентрации вещества приведены в табл. 2.1.
Таблица 2.1
Концентрация вещества.
Концентрация. | Уравнение. | Единица измерения. |
Массовая доля. | т т | %, млн-1 |
Молярная доля. | v «Ы 1 ««(*). | %, млн-1 |
Окончание табл. 2.1
Концентрация. | Уравнение. | Единица измерения. |
Объемная доля. | с,=^. 1 V | %, МЛН" 1 |
Массовая концентрация. | т w = — V | кг/м3, мг/л. |
Молярная концентрация. | л. ^ s: II. 'Ti' о. | моль/м3 |
Концентрация молекул (концентрационная плотность частиц). | о. II. | части ц/м3 |
Свойства веществ характеризуются числовыми значениями физических или физико-химических величин, например плотности, вязкости, электрической проводимости и т. п., поддающихся измерениям.
Между условными частицами в соединении существуют определенные соотношения, называемые стехиометрическими. Например, в NaCl на один атом натрия приходится один атом хлора, в молекуле H2S03 два протона связаны с одной частицей S032_. Между реагирующими частицами также устанавливаются стехиометрические отношения, например в реакции.

а условных единиц вещества А реагируют с b условными частицами вещества В. Следовательно, одна частица А эквивалентна — частицам вещества.
ь а
В при условии, что а>Ь. Отношение — называют фактором эквивалент;
а
ности вещества В и обозначают как /экв(В).
Вещества реагируют между собой эквивалентами по закону Дальтона (J. Dalton — английский химик и физик, 1766—1844). Это закон является основой всех количественных расчетов в аналитической химии, особенно в титриметрических методах анализа. На практике имеют дело не с отдельными эквивалентами или единичным химическим актом, а с большими совокупностями частиц. В этом случае стехиометрические соотношения между веществами проявляются в соотношении количеств веществ п{А) и п (В) в молях:
